MENGHITUNG pH ASAM LEMAH

Foto di atas merupakan foto cuka dalam suatu kemasan. Kalau Anda cicipi, rasanya asam. Seberapa asam? Ukuran yang digunakan untuk menentukan derajat keasaman suatu asam adalah pH. Seperti yang telah Anda ketahui, dalam ilmu kimia, suatu larutan yang bersifat asam mempunyai pH < 7, larutan yang bersifat basa memiliki pH > 7 sedangkan larutan yang netral memiliki pH = 7. Bagaimana cara menghitung derajat keasaman (pH) suatu asam?
Pada prinsipnya, untuk menghitung pH suatu asam, yang harus dihitung sebelumnya adalah konsentrasi ion H+, yaitu [H+]. Setelah mendapatkan [H+], kita gunakan rumus
pH = -log [H+]
Cara menghitung [H+] itu sendiri beraneka ragam macamnya. Beberapa hal yang perlu dipertimbangkan misalnya apakah larutan tersebut merupakan asam kuat atau asam lemah? Basa kuat atau basa lemah? Apakah larutan tersebut merupakan larutan penyangga (larutan buffer)?
Pada posting kali ini, yang dibahas adalah menghitung pH suatu asam lemah. Untuk asam lemah monobasa, dua rumus yang sering digunakan adalah:
[pmath] delim{[}{H^+}{]}=sqrt{K_{a}.a}[/pmath] ………………………………………………………………….. (1)
atau [pmath] delim{[}{H^+}{]}=a alpha[/pmath] ………………………………………………………… (2)
Dalam hal ini, Ka = tetapan kesetimbangan ionisasi asam, α = derajat ionisasi asam, dan a = konsentrasi asam yang akan dihitung pH-nya.
Perlu juga diperhatikan hubungan antara Ka dan α sebagai berikut:
[pmath]alpha=sqrt{{K_{a}}/a}[/pmath] ……………………………………………………………………. (3)
Contoh Soal 1
Tentukanlah pH asam cuka (CH3COOH) yang memiliki konsentrasi 0,1 M apabila diketahui Ka = 1,75.10-5 .
Jawab:
Dalam soal ini, a = 0,1 M dan Ka = 1,75.10-5 M sehingga dari rumus (1) diperoleh
[pmath] delim{[}{H^+}{]}=sqrt{(1,75.10^{-5}).0,1}~M=1,32.10^{-3}~M[/pmath]
dan pH = – log (1,32.10-3) = 3 – log 1,32 = 3 – 0,12 = 2,88.
Contoh Soal 2
Diketahui derajat ionisasi asam hipoklorit (yaitu HClO) adalah 0,00173. Berapakah pH 0,01 Molar asam tersebut?
Jawab:
Dalam soal ini, α = 0,00173 dan a = 0,01 M, sehingga dari rumus (2) diperoleh:
[H+] = 0,01.0,00173 M = 1,73.10-5 M
sehingga pH = – log (1,73.10-5 = 5 – log 1,73 = 4,76.
Contoh 3
Berapakah derajat ionisasi suatu asam lemah HX dengan konsentrasi 0,1 mol/L dan tetapan kesetimbangan ionisasi asam 10-9?
Jawab:
Pada soal ini, Ka = 10-9 dan a = 0,1. Substitusikan nilai-nilai ini ke rumus (3), diperoleh:
[pmath]alpha=sqrt{{10^{-9}}/{0,1}}=10^{-4}[/pmath]
Namun hati-hati apabila asam lemah yang akan kita hitung pH-nya merupakan asam lemah dibasa. Ingatlah bahwa ionisasi asam lemah dibasa berlangsung dalam dua tahap. Anggaplah asam lemah dibasa tersebut adalah H2X. Kesetimbangan yang terjadi adalah sebagai berikut:
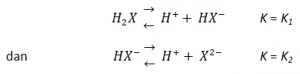
Apabila [pmath]{K_{1}}/{K_{2}}>=10^5[/pmath] dan konsentrasi asamnya tidak terlalu kecil, H+ yang terbentuk dari ionisasi tahap kedua dapat diabaikan, sehingga tetapan kesetimbangan yang disubstitusikan ke dalam rumus (1) adalah K1. Selanjutnya, dapat dibuktikan bahwa [X2-] = K2.
Contoh 4
Diketahui ketetapan kesetimbangan ionisasi asam tahap 1 dari asam askorbat (H2C6H6O6) adalah 8.10-5 dan tahap keduanya adalah 1,6.10-12. Berapakah pH 0,2 M asam ini?
Jawab:
Asam askorbat merupakan suatu asam dibasa, dengan perbandingan [pmath]{K{1}}/{K_{2}}={8,0.10^{-5}}/{1,6.10^{-12}}=5,0.10^7 >= 10^5[/pmath] sehingga H+ yang berasal dari ionisasi tahap kedua dapat diabaikan. Substitusikan Ka = K1 dan a = 0,2 M ke dalam (1), diperoleh
[pmath]delim{[}{H^+}{]}=sqrt{(8.10^{-5}).0,2}~M=sqrt{16.10^{-6}}~M=4.10^{-3}~M[/pmath]
sehingga pH = – log (4.10-3) = 3 – log 4 = 2,398.
Tagging: asam lemah, derajat keasaman, pH


tentukan konsentrasi ion H+dari
1.larutan HCN 0,02 m.jika ka :6,2×10-10
1,32 itu dapat darimana